⟪Genet法說筆記⟫ 北極星(6550)軟組織肉瘤二期今年5月於美國臨床腫瘤學會(ASCO)上發布 2024年期望拿下兩張藥證
北極星藥業(6550)專注於開發癌症新藥ADI-PEG20,主要是針對精氨酸(L-Arginine)抑制劑機轉所設計的標靶型抗癌藥物,目前以惡質肺間皮癌、軟組織肉瘤、肝癌、腦癌等癌症為主要適應症,正在進行對各適應症的人體臨床實驗。陳鴻文董事長近日針對旗下ADI-PEG20的臨床試驗進展以及公司未來在新藥與CDMO的發展策略上進行說明,Genet為大家整理相關重點:
陳鴻文董事長表示,2021年下半年至少開展3個ADI-PEG20的臨床III期試驗,並目標於2024年至少拿到2張藥證。

專注癌細胞代謝重磅新藥ADI-PEG20 不限單一癌症為發展優勢
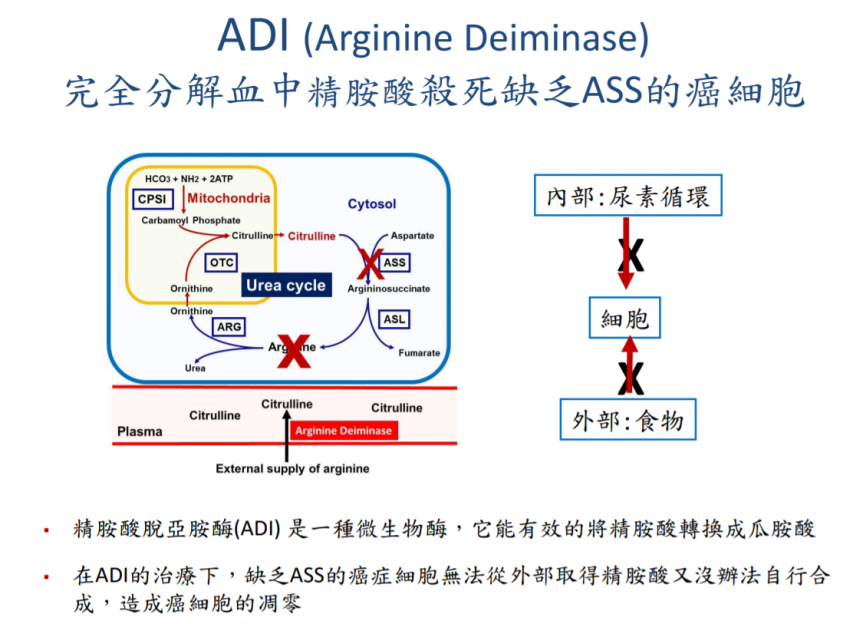
精胺酸(L-Arginine)為人體必需胺基酸的一種,部分癌細胞缺乏尿素循環中的關鍵酶ASS,因此癌細胞無法自行合成所需的精胺酸,需要透過外部的營養吸收來維持運作。精胺酸脫亞胺酶(ADI)是一種微生物酶,能有效將精胺酸轉換成瓜胺酸,藉此讓缺乏ASS的癌細胞無法從外部取得精胺酸也無法自行合成,透過切斷癌細胞的能量供給造成癌細胞死亡,正常細胞則不會受到影響。特別的是,ADI-PEG20作用機制屬於代謝療法,因此不限單一癌症種類,藥物的副作用也相對較低。
1. 惡性肺間皮癌(Malignant Pleural Mesothelioma, MPM)
針對MPM的臨床試驗為ADI-PEG20合併一線用藥(Pemetrexed+Cisplatin)進行治療的多國多中心、II/III期聯合臨床試驗,預計招募386位病患,截至二月已收錄232位病患並由獨立專家小組進行期中分析。根據目前所觀察到之狀況,估算在試驗結束後總體生存期(Overall Survival, OS)可獲得統計上顯著效果的機率(Conditional Power, CP)大於80%,審議會建議按原申請計畫持續進行III期臨床試驗。北極星預計還需再收150位病患,以期在2022年底前完成III期臨床試驗的收案。(延伸閱讀:北極星(6550)肺癌臨床三期期中分析 審議會建議持續進行三期臨床試驗)
2. 軟組織肉瘤(Soft Tissue Sarcoma, STS)
針對STS的臨床試驗由美國華盛頓大學主導,經費由華盛頓大學NIH補助,主要療效指標為疾病無惡化存活期(Progression-Free Survival, PFS)、次要療效指標則是客觀緩解率(Objective Response Rate, ORR)。目前已收完II期臨床試驗的75位病患,臨床試驗數據將於今年5月於美國臨床腫瘤學會(ASCO)上發布,並預計2021年下半年向美國FDA申請有條件式許可後啟動臨床III期試驗。
3. 肝癌(Hepatocellular Carcinoma, HCC)
原先將ADI-PEG20合併化療FOLFOX治療肝癌的II期臨床試驗已於2020年1月終止,近期透過初期研究數據發現ADI對具有某種基因變異的肝癌病患療效特別好,該基因變異約佔整體肝癌病患的8%,因此北極星計畫於2021年下半年針對肝癌重啟ADI-PEG20單藥的III期臨床試驗,預計納入基因篩選並收納約180位病患。
4. 腦癌(Glioblastoma Multiforme, GBM)
針對GBM的臨床Ib試驗仍在進行中,計畫在台灣招募20位病患。(延伸閱讀:北極星(6550) 全球「腦瘤剋星」魏國珍副院長領頭 啟動FDA及TFDA核准1B期腦癌臨床之收錄病人)
生物製藥工廠穩定發展 CDMO未來將擴張mRNA量產技術
北極星的生物製藥工廠除了將負責ADI-PEG20上市後的量產製造,也有與美國國家實驗室spin-off出來的Nanotein Technologies針對下一代CAR-T培養液合作量產製程開發,北極星將擁有未來Nanotein Technologies銷售額的15%權利金,預計2022年上半年開始量產出貨。
此外在CDMO方面,北極星也正致力於建置mRNA量產技術,此也為未來疫苗發展的重要趨勢,此外,除了美國與成都工廠外,台灣工廠預計3-4年後加入營運,屆時將完成美、中、台三地生產策略,強化北極星發展CDMO的國際競爭力。


.jpg)

