【頭大大】壓力!? 國產疫苗全球三期臨床試驗最大挑戰- 是一定要成功????
根據報導,國產疫苗將在六月解盲,最快月底就可以施打,之後將向歐盟申請海外三期臨床試驗,以用來取得國際認證,替未來「疫苗護照」鋪路。問題是,如果國產疫苗已經有數百萬人甚至上千萬人施打了,萬一三期不如預期,該怎麼辦???
一. 國產疫苗二期如何過關?
二. 台灣多少人打國產疫苗?
三. 為了取得「疫苗護照」將在海外啟動三期
四. 海外三期臨床試驗最大挑戰???
一. 國產疫苗二期如何過關?
根據報導,國產疫苗二期臨床數據,將採用抗體相關性指標的比較(疫苗效力的替代指標 Correlates of Protection,COP)來取得台灣TFDA的緊急使用授權 (COP是否已經列為先進國家和WHO的準則? 必須追蹤,相信我們衛福部也會尊重)。只是,面對詭譎多變、從所未見的病毒,我們必須以更謙卑、更嚴謹、更具科學驗證的態度來面對。
參考輝瑞/BNT三期臨床試驗期中分數據示意圖-約四萬四千受試者在疫區執行,FDA看的不是中和抗體的產生,而是看到疫苗可以有效預防新冠的發生,同時以年齡、性別、種族、族裔、BMI 和是否有多重共存疾病進行的亞組分析顯示,疫苗效力與在總體人群中觀察到的(國產疫苗二期能夠提供除族裔外的外的這些數據?)。
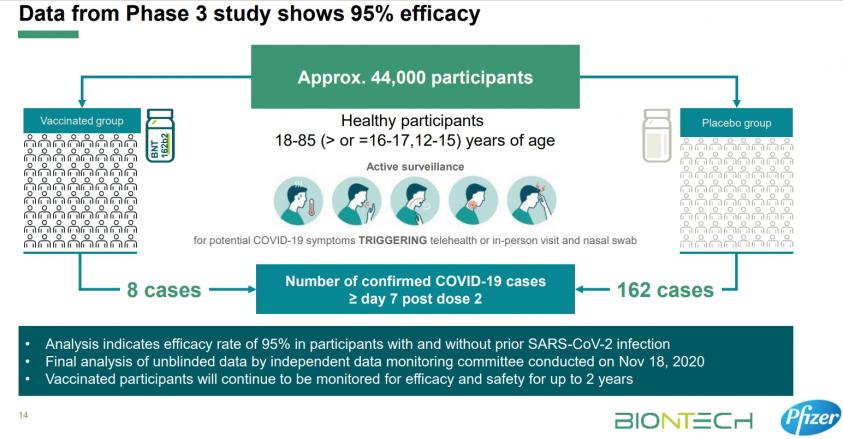
二. 台灣多少人打國產疫苗?
國產疫苗如果經過台灣衛福部EUA的認可後,因為政府一家已經採購合計500萬劑疫苗採購,另附上限500萬劑之後續擴充,所以兩家可能高達兩千萬劑,如果以此推,又加上自費也無法自行選擇新冠疫苗的話,台灣恐怕有將近五百萬到一千萬人接種國產疫苗(包括軍、公、教、學生??)。(閱讀: 張鴻仁-公費疫苗才需政府出面)
參考輝瑞/BNT三期臨床試驗有效力: 清楚告訴你-打了第一劑疫苗後12天展現保護力,第二劑7天後可達95%的保護力 (該數據發表在全球最知名NEJM),所以國產疫苗可以告訴我們第一劑和第二劑的保護力? 要多久可以產生保護力?
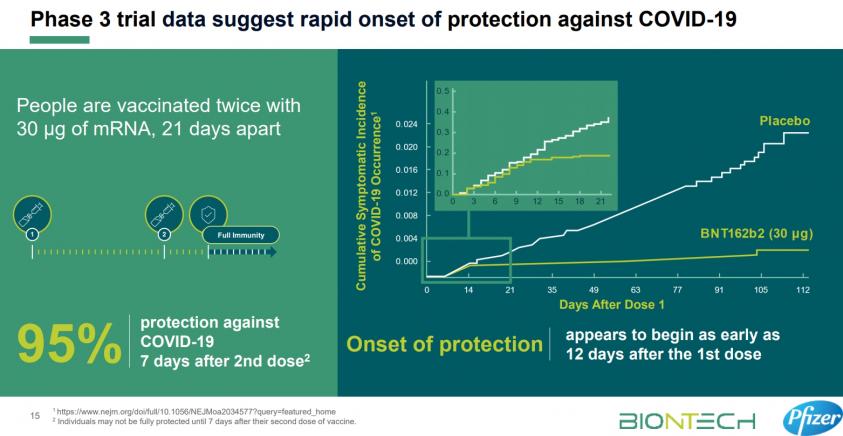
參考輝瑞/BNT三期臨床試驗安全性: 清楚告訴你-收集3萬8千人的安全數據顯示頭痛2%、疲累3.8%

三. 為了取得「疫苗護照」將在海外啟動三期
閱讀: 《FDA》申請緊急使用授權EUA 廠商需要提交三期臨床試驗的那些安全性和有效性的數據? 以輝瑞為例
1. 根據報導,二期之後,將向歐盟申請三期臨床試驗,至於詳細還沒公告,不過應不應該要驗證能夠預防重症?
2. 相信公司也不會只有向歐盟申請認證,如果公司為了展現在全球的競爭力,美國也應該列入考慮。
3. 三期臨床試驗根據國際大廠是需要執行多國、多中心的臨床試驗,以涵蓋更多人種、年齡、以及有慢性病等,也有利未來全球上市銷售。
4. 是否未來三期還可以採取抗體相關性指標的比較? 這需要與FDA來討論(也不是WHO說了算...),尤其現在第一代疫苗的有效性已經高達95%,所以後來者是不是需要與大廠疫苗進行頭對頭的試驗?(對照組是輝瑞、Moderna或是嬌生,還是Novavax) ?
5. 要比較保護力優於還是不劣於對照組?
6. 只求過關,還是有要向全球大廠挑戰的企圖心? 以及未來如果要進軍全球市場,三期的量產不是只求速度還有規模,以及產品的穩定性。
四. 海外三期臨床試驗最大挑戰
最後,國產疫苗最大挑戰在三期臨床試驗,不是人數(花錢就是)也不是疫區(無論疫苗怎麼打,疫區還是會有,還是未來允許抗體相關指標的比較)? 而是數百萬或是千萬台灣人已經打了國產疫苗的話,三期臨床試驗是只許成功不許失敗? 雖然二期成功也不保證三期可以百分之百的成功,不過頭大大還是期待國產疫苗可以取得美國FDA和歐盟的核准,行銷全世界。
發展疫苗是國家戰略,就像台灣研發武器,我們還是要對外採購(好像用來打對方的武器也沒有被阻礙...),所以國內發展和海外採購同步進行是必須的,現在我們就少點、少點「炒股」口水,更專業、更科學的來觀察、來學習國際大廠臨床試驗的設計 (現在全球已經有18億人打了疫苗),以及他們最新疫苗的研發趨勢-對抗更詭異的變種病毒、提供更方便的口服和鼻噴疫苗。
美國FDA在新藥研發的一期、二期臨床試驗,因為數據非常好,就有條件的核准上市,不過治療對象可能是數百人、數千人都很有限,不像疫苗的使用對象是數百萬人,甚至上億人,所以FDA此次對疫苗EUA核准,都是要求需要至少有一個清楚令人信服的三期臨床試驗的數據(最終或是期中分析的觀察指標必須先與FDA討論)。



.jpg)


