《CAR-T》韓國三星醫療中心與CuroCell建置新一代 CAR-T 細胞治療GMP廠
2020 年,韓國三星醫療中心 (Samsung Medical Center, SMC,韓國最大的醫院之一) 與臨床階段的生物技術開發公司 CuroCell 簽訂了臨床開發合作協議,並設立了 GMP 工廠。

今年 2 月底,韓國食品藥物安全部 (Ministry of Food and Drug Safety, MFDS) 批准了 Curocell「CRC01」的 IND 申請,成為第一種「降低免疫檢查點受體 PD-1、以 CD19 為標靶的 CAR-T 細胞療法」,用於治療復發或難治性 (r/r) 瀰漫大 B 細胞淋巴瘤 (DLBCL) 患者。
4 月 28 日,韓國三星醫療中心SMC 進一步表示,已經在其 CAR-T 細胞治療中心完成了對復發性或難治性 DLBCL 患者的 CAR-T 細胞治療,並將在該中心進行 II 期臨床試驗。
此外,韓國三星醫療中心SMC 還已經完成了執行諾華 (Novartis) 公司 Kymriah 的準備工作,以利治療 25 歲以下、接受標準化療後病情並未好轉的 DLBCL 和急性 B 細胞淋巴細胞白血病患者。
* 補充:
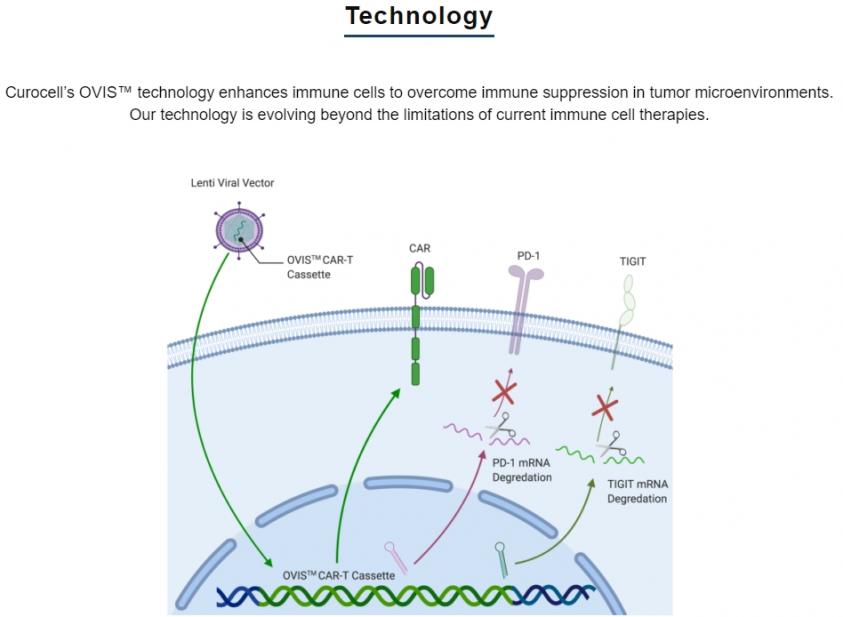
CRC01 是透過 OVIS™ 平台開發而來。OVIS™ 平台利用慢病毒 (lentivirus) 載體,對患者的 T 細胞進行改造,透過下調 PD1 和 TIGIT 以克服腫瘤微環境中的免疫抑制,也因此,具有應用於實體腫瘤的潛力。
延伸閱讀:《FDA》更安全CAR-T 細胞療法!施貴寶 Breyanzi (liso-cel) 治療復發或難治性 (R/R) 大型 B 細胞淋巴瘤 (LBCL) 批准了
延伸閱讀:《CAR-T》臨床試驗顯示67%患者完全緩解,FDA授與Gilead/Kite治療難治型套細胞淋巴瘤KTE-X19 優先審核
資料來源:Korea Biomedical Review、Pulse News、PR Newswire、CuroCell