《思覺失調》Karuna Therapeutics候選新藥 KarXT不依賴多巴胺能或血清素治療! 分析師估銷售可達44億美元
Karuna Therapeutics 3/20日表示,其三期 EMERGENT-3 試驗評估 KarXT(xanomeline-trospium)用於成人精神分裂症的療效、安全性和耐受性。該試驗達到了其主要終點,與安慰劑相比,KarXT 在活性與負性症量表綜合徵量表 ((Positive and Negative Syndrome Scale, PANSS) 總分上顯示出具有統計學意義和臨床意義的 8.4 分降低(-20.6 KarXT 對比安慰劑 -12.2;p<0.0001)。早期的 II 期試驗在 2021 年也取得了積極成果。
公司即將在第二季度初召開的 NDA 前會議,並繼續按計劃在 2023 年年中提交 NDA。2023/03/21公司股價為182.5美元市值為63億美元。瑞穗分析師預計美國銷售額峰值為 44 億美元
關於 EMERGENT-3 試驗
1. 三期 EMERGENT-3 試驗是一項雙盲、安慰劑對照、為期五週的住院試驗,共有 256 名患有精神分裂症的成年人(年齡在 18-65 歲之間)參加了該試驗。入組患者確診為精神分裂症,並且在入組時出現精神病症狀。
2. 評估研究療法 KarXT 與安慰劑相比在成年精神分裂症患者中的療效、安全性和耐受性。主要終點是第 5 週時與安慰劑相比,KarXT 陽性和陰性症狀量表 (PANSS) 總分(衡量精神分裂症症狀嚴重程度的量表)相對於基線的變化。預先指定的次要終點包括 PANSS 陽性、PANSS 陰性和 KarXT 相對於基線的變化。與安慰劑相比,第 5 週時 KarXT 的 PANSS 陰性 Marder 因子子量表。
3. 患者以 1:1 的比例隨機接受靈活劑量的 KarXT 或安慰劑,每天兩次 (BID),持續五週。在第 1-2 天,患者接受劑量為 50/20 的 KarXT(50mg xanomeline/20mg trospium)BID 或匹配的安慰劑。在第 3 天,患者將劑量增加到 100/20 BID,在第 8 天,患者可以根據耐受性選擇增加到 125/30 BID。在該試驗中,79% 的 KarXT 患者與 91% 的安慰劑患者滴定至最高劑量水平 (125/30 BID)。
KarXT (xanomeline-trospium)
1. KarXT 是一種口服的、研究性 M1/M4 優先毒蕈鹼激動劑,目前正在作為治療精神分裂症以及治療阿茲海默症之精神病的單一療法和輔助療法的三期臨床試驗進行評估。M1 和 M4 受體的活動間接影響大腦區域的多巴胺神經傳遞,這些大腦區域參與調節嚴重精神疾病的症狀,例如阿茲海默病中的精神病,以及精神分裂症的陽性、陰性和認知症狀
2. KarXT 利用毒蕈鹼受體並且通過其新穎的作用機制,不依賴多巴胺能或血清素能途徑來治療嚴重精神疾病的症狀,可以提供一種治療精神和神經疾病的新方法。
3. KarXT 由毒蕈鹼激動劑 xanomeline 和毒蕈鹼拮抗劑 trospium 組成,旨在優先刺激 中樞神經系統(Central Nervous System,縮寫CNS) 中的毒蕈鹼受體,並釋放 xanomeline 的治療潛力,同時改善早期研究中出現的副作用。
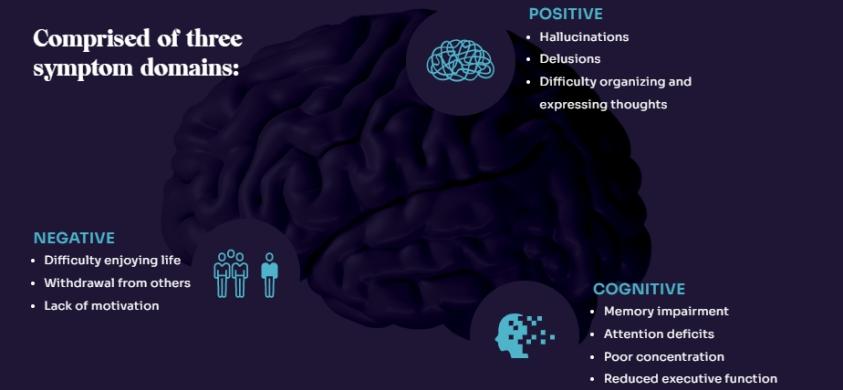
全球有2100萬人受精神分裂症之苦
其中大多數人在 18 個月內停止服用目前的抗精神病藥物治療方案。社交退縮、幻覺、妄想、記憶擦除、決策障礙和其他症狀是該病症的標誌。


.jpg)

