《兒童腦瘤》整體緩解率((ORR)高達51%!! FDA加速核准 Day One Biopharma治療兒童腦瘤BRAF抑制劑新藥Ojemda(tovorafenib) (閱讀)
常見的兒童中樞神經系統(CNS)腫瘤是小兒低度膠質瘤(Paediatric Low Grade Gliomas,pLGG),佔兒童所有中樞神經系統腫瘤的30%-40%。這些腫瘤通常採用較舊的療法進行治療。被診斷為低度神經膠質瘤的兒童如果符合條件,通常會先接受手術。大約三分之一的腫瘤被完全切除;對於其餘患者來說,剩下的選擇是化療(可能還有幾輪),然後是放射治療,這可能會帶來短期和長期副作用。

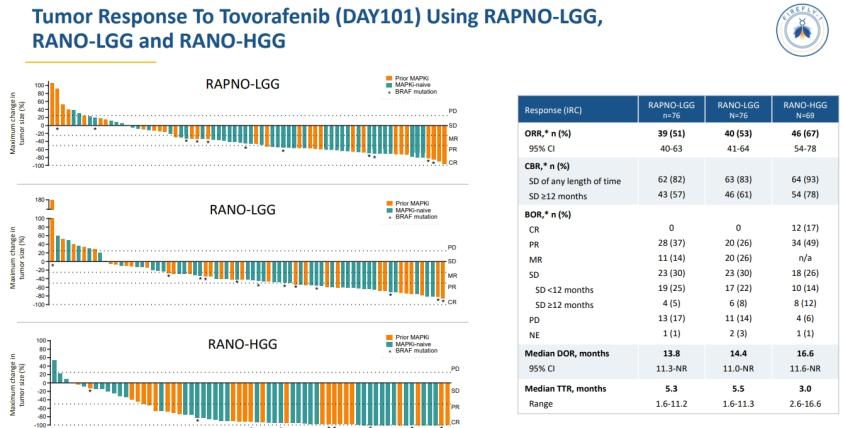
2024 年4 月23 日,Day One Biopharma宣布美國FDA批准II 型RAF 抑製劑Ojemda(tovorafenib)用於治療6 個月及以上帶有有 BRAF 融合或重排或 BRAF V600 突變的難治性和復發型的 pLGG。此適應症根據腫瘤反應率和持續時間在加速批准下獲得批准。加速批准是基於 FIREFLY-1 2 期研究的結果,其中 51% 的患者在接受 Ojemda 治療後發現腫瘤縮小了至少 25%。在 76 名患者中,28 名患者出現部分緩解(意味著他們的腫瘤縮小了至少 50%),11 名患者出現輕微緩解-他們的腫瘤縮小了 25% 至 49%。
加州大學舊金山分校貝尼奧夫兒童醫院兒科神經腫瘤學家Sabine Mueller 博士表示:「pLGG 是一種慢性且持續的癌症,可以摧毀兒童及其家人,常常奪走他們的視力、平衡能力和言語能力。 「pLGG 治療的目標是穩定或縮小腫瘤,而不進一步擾亂兒童和家庭的生活。從歷史上看,對於復發的 pLGG 兒童並沒有標準的照顧。現在有了一種新的有針對性的治療方案,每週一次口服給藥,專為這些孩子及其家人設計。
臨床試驗
1. 最佳整體緩解 ORR 為 51%(95% CI:40 - 63),其中包括 28% 的 部分反解PR 和10%輕微緩解(MR)。
2. 在 64 名 BRAF 融合或重(BRAF fusions or rearrangements)患者中,OJEMDA 的 ORR 為 52%,在 12 名 BRAF V600 突變患者中,ORR 為 50%。
3. 45 名先前接受過 MAPK 標靶治療的患者的 ORR 為 49%,而 31 名先前未接受過 MAPK 標靶治療的患者的 ORR 為 55%。
截至 2023 年 6 月 5 日資料截止,RAPNO LGG 的中位緩解持續時間為 13.8 個月。此外,截至目前,66% 的患者仍在研究並繼續接受治療。開始治療後,OJEMDA 出現反應的中位數時間為 5.3 個月(範圍 1.6、11.2)。
4. 該治療以片劑和口服混懸液的形式提供。該藥物帶有安全警告和預防措施,表明它可以減緩身高增長。 Day One 的研發主管 Sam Blackman 表示,這種效應似乎是可逆的,"患者停藥後似乎會恢復過來。"
OJEMDA
是是突變型 BRAF V600、野生型 BRAF 和野生型 CRAF 激酶的 II 型 RAF 激酶抑制劑,FDA核准為處方藥,用於治療 6 個月及以上患有 BRAF 融合或重排或 BRAF V600 突變的複發或難治性兒童低度膠質瘤 (LGG) 患者。這是一種兒科低度膠質瘤(LGG),並且在先前的治療後復發或對先前的治療沒有反應並且具有某種類型的異常"BRAF"基因。
OJEMDA 是 FDA 批准的第一個也是唯一一個用於治療 BRAF 融合或重排兒童的藥物,BRAF 融合或重排是 pLGG 中最常見的分子改變,BRAF 是 pLGG 中最常見的改變基因,高達 75% 的兒童有 BRAF 改變。

.jpg)



