《COVID-19 檢測》Quidel 公司的家用檢測試劑組獲 FDA 授予緊急使用授權
去年年底,FDA 針對一些新冠肺炎的家用檢測試劑授予了緊急使用授權 (EUA),像是需要醫師處方的 Lucira Health 的分子檢測試劑組、亞培的家用快速抗原測試試劑組,還有 Ellume 的非處方檢測產品等。
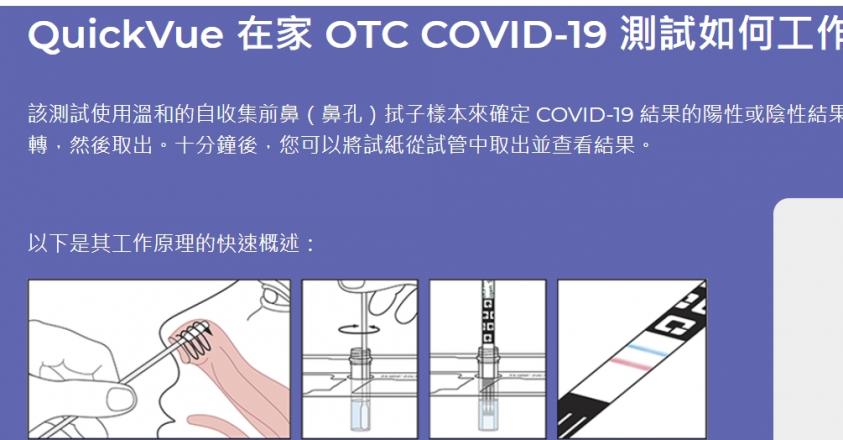
3 月初,FDA 又批准了 Quidel 公司的「QuickVue At-Home COVID-19 Test」。該產品可在症狀出現後六天內檢測到樣本中 SARS-CoV-2 核蛋白鞘抗原的存在,並可於 10 分鐘內取得結果。目前該試劑組仍需要醫師處方才可取得,但民眾可以在家自行採樣、操作,適用於 8 歲以上的民眾;其陽性與陰性的檢測結果,與 RT-PCR 的一致性分別是 84.8% 與 99.1%;靈敏度低於 QuickVue 系列中、另一項設計給專業醫療人員使用的產品,但這可能是因為是民眾自行採樣時採樣位置不夠準確所致。(延伸閱讀:《COVID-19檢測》靈敏度高達96.7%直逼PCR!美國政府採購Quidel和BD的快速抗原檢測用於養老院)

搭配「QuickVue At-Home COVID-19 Test」的,還有另一項由 CareEvolution 公司開發的智慧型手機應用程式「MyDataHelps」,它可以提供執行檢測的逐步說明以及計時器等工具,以確保使用者可以準確地執行檢測步驟;此外,它還可以透過手機的相機拍攝、協助判讀測試結果。目前該應用程式正由美國國立衛生研究院 (NIH) 資助進行性能與可用性的評估,該研究已經招募了 200 多名受試者,將連續 14 天接受測試。
其實早在幾年前,Quidel 公司就曾針對流感與鏈球菌開發過家用檢測試劑組,只是後續沒有商品化;但現在隨著大眾對傳染病的了解,家用檢測試劑組反而變得很受重視,且這類產品除了可以節省時間、減少醫護人員感染風險外,也可以讓醫生或遠距醫療服務提供者快速決定適當的治療方案。
Craig-Hallum 的一位分析師認為,這次授予的 EUA 是「將家用檢測試劑轉化成數十億美元市場的第一步」,不過,還必須取得非處方批准才能真正釋放該產品的全部商業潛力;只是 Quidel 公司 2 月時表示,現在還需要時間來改善在無症狀患者中的檢出率,因此在申請非處方試劑的進度上還有些落後。
延伸閲讀:《COVID-19 檢測》只需指尖滴血! 微流控技術搭配智慧型手機,60分鐘快速檢測新冠肺炎
資料來源:FierceBiotech、MedTech Dive、Medical Device Network