《FDA》核准首個T細胞結合雙特異性抗體( CD20xCD3 )之基因療法 ! 羅氏/Genentech治療淋巴瘤之Lunsumio(mosunetuzumab)可於門診進行(必讀)
2022年12月23日,羅氏大藥廠宣布,美國FDA已核准 Lunsumio® (mosunetuzumab-axgb) 用於治療復發或難治性( R/R) 二線或多線全身治療後的濾泡性淋巴瘤 (FL)。Lunsumio 的高反應率和固定持續時間可能會改變晚期濾泡性淋巴瘤的治療方式,未來數周將於美國上市,不過因為是加速審核資格下取得核准,三期臨床確認試驗仍需進行,預計在2023/2024取得數據。
二期臨床試驗結果取得核准
T 細胞結合雙特異性抗體Lunsumio
Lunsumio競爭者
濾泡性淋巴瘤市場
關於 GO29781二期和三期臨床試驗
二期臨床試驗結果取得核准
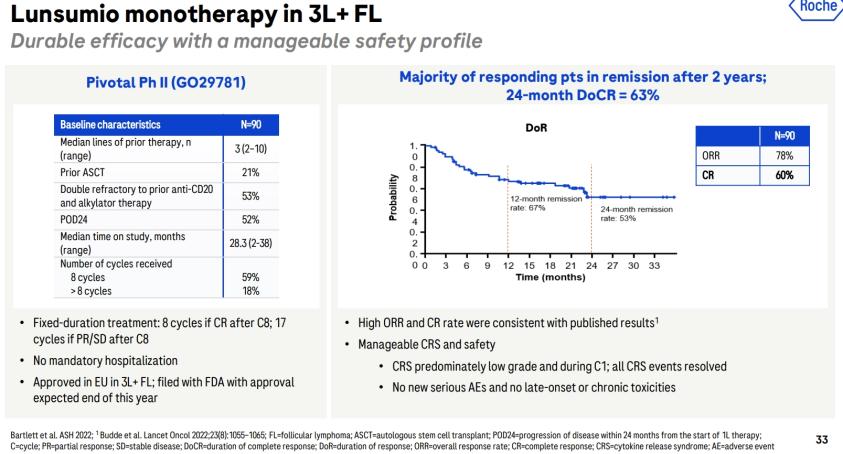
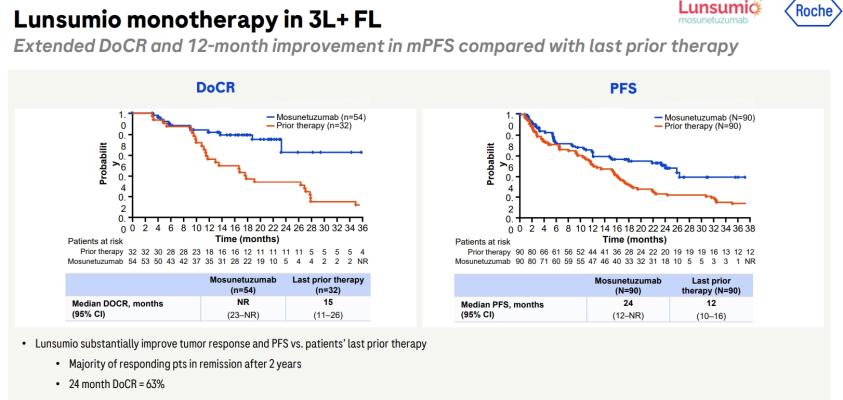
1. 濾泡性淋巴瘤患者經過多線治療後可於門診使用,非化療,且能透過持續、固定時間靜脈內輸注給藥Lunsumio來獲得病情緩解
2. 關鍵二期臨床事件 GO29781 的數據顯示,接受過至少兩種既往治療的患者中有 80% 達到了持久反應率,至少維持18個月,其中 60% 經歷了完全緩解
3. Lunsumio現在是 FDA 批准的第一個 CD20xCD3 T 細胞結合雙特異性抗體,用於治療最常見的緩慢生長型的非霍奇金淋巴瘤、濾泡性淋巴瘤
4. 218 名血液系統惡性腫瘤患者中,最常見的不良事件 (AE) 是細胞因子釋放綜合徵 (CRS;39%),這可能是嚴重的並危及生命。CRS 事件的中位持續時間為三天。其他常見的不良事件 (≥20%) 包括疲勞、皮疹、發熱和頭痛。
5. 該適應症根據之前因為臨床試驗反應率而取得加速審核(accelerated approval)資格下獲得FDA核准。(延伸閱讀: 《FDA》加速審核核准(Accelerated Approval)越嚴格對大廠有利,小生技公司恐將面臨募資困難)
T 細胞結合雙特異性抗體Lunsumio
是一種 CD20xCD3 T 細胞結合雙特異性抗體,代表了一類新型的固定持續時間的癌症免疫療法,它是現成的且隨時可用,因此患者無需等待開始治療。
Lunsumio競爭者
它與諾華公司的 Kymriah、百時美施貴寶公司的 Breyanzi 和吉利德公司的 Yescarta 展開競爭。不過,CAR-T治療需要復雜的製造過程,需要患者等待數週才能在指定的治療中心進行輸液,羅氏希望透過其門診使用方便性來競爭。(延伸閱讀:《細胞療法》新里程碑! 歐盟通過全球第一個『同種異體』T細胞免疫療法, Atara的 Ebvallo可在門診治療 )
相比之下,CAR-T 療法 Kymriah 在其期 ELARA 試驗中引發了 86% 的患者反應,其中 69% 的患者完全緩解。Yescarta 在其早期 ZUMA-5 研究中的反應率為 94%,完全反應率為 79%。
濾泡性淋巴瘤市場
濾泡性淋巴瘤 (FL) 是非霍奇金淋巴瘤中最常見的緩慢生長形式,約佔五分之一。通常對治療反應良好,但通常以緩解期和復發期為特徵。每次患者復發時,這種疾病通常會變得更難治療,早期進展可能與長期預後不良有關。據估計,在美國,到 2022 年將診斷出約 13,000 例新的 FL 病例,全世界每年有超過十萬人被診斷出患有 FL。
關於 GO29781二期和三期臨床試驗
GO29781 研究 [ NCT02500407] 是一項二期、多中心、開放標籤、劑量遞增和擴展研究,評估 Lunsumio® (mosunetuzumab-axgb) 在復發或難治性 B 細胞非霍奇金淋巴瘤患者中的安全性、有效性和藥代動力學。結果指標包括完全反應率(最佳反應)(主要終點)、客觀反應率、反應持續時間、無惡化生存期、安全性和耐受性(次要終點)。預期2023/2024取得三期臨床試驗最終數據。


.jpg)