《肺動脈高壓》 每三周一次 ! Merck活化素信號抑制劑 Sotatercept (WINREVAIR)獲FDA核准 新一代療法進入市場競爭
肺動脈治療新藥已經從每天吸入藥物四次,到每天口服一次藥物,進而三週使用一次注射就可大大提升身體血流和行動力。
Sotatercept-csrk-WINREVAIR獲FDA核准用於肺動脈高壓治療
預估2030年銷售達50億美元 成為默沙東成長動能之一
三期臨床數據:六分鐘步行距離從基線增加了41 公尺,大大提升病患行動力
市場競爭者眾: Gilead Sciences ; United Therapeutics、輝瑞等
關於肺動脈高壓 (PAH) : 美國大約有 40,000 人罹患此罕病
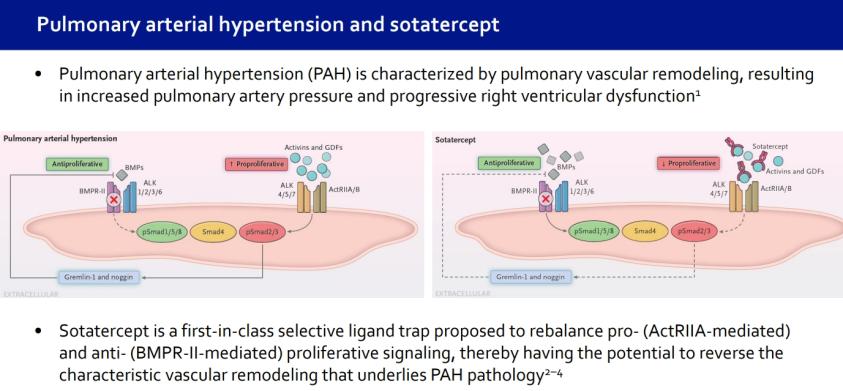
每三周一次!WINREVAIR: 一種激活素信號抑製劑生物製劑
2024年3月26日,默沙東宣布,美國FDA已批准sotatercept-csrk-WINREVAIR™(美國品牌名,每三週透過皮下注射給藥一次之注射型,45mg、60mg),用於治療患有肺動脈高壓(PAH,世界衛生組織[WHO]第1組)成人病患,以增加運動能力,提高WHO功能分級(FC),並降低肺動脈高壓的風險臨床惡化事件。 WINREVAIR 是 FDA 批准的首個針對 PAH 的活化素訊號抑制劑療法,代表了一類新型療法。(延伸閱讀: 國邑(6875)開發藥械合一治療肺動脈高壓微脂體吸入劑 進入三期臨床試驗)
這項批准對默克來說至關重要,隨著其最暢銷的癌症免疫療法Keytruda將於 2028 年失去市場獨佔權,該公司正在努力實現收入來源多元化。摩根大通分析師 Chris Schott 在本月的報告中估計,到 2030 年,Winrevair 的全球年銷售額將達到 50 億美元左右,並成為默沙東公司「最大的成長動力」之一。
三期臨床試驗
1. WINREVAIR (n=163) 與安慰劑(n=160) 進行比較,兩者均結合成人PAH 患者(WHO 第1 組FC II 或III 組)護理治療的背景標準。結果顯示,在第24 週時,將WINREVAIR 添加到背景治療中,使六分鐘步行距離從基線增加了41 公尺(95% CI:28, 54;p<0.001;安慰劑調整),並顯著改善了多項重要的次要結局指標,包括減少與單獨背景治療相比,全因死亡或PAH 臨床惡化事件的風險降低84%(事件數:9 vs 42,風險比=0.16;95% CI:0.08 ,0.35;p<0.001)。
2. 默沙東首席醫療官 Eliav Barr表示,人們的鍛鍊和活動能力因而有了巨大的提高,是一項很大的轉變,因為這種疾病導致人們呼吸急促,無法動彈,不得不非常非常宅在家。
3. 默沙東公司正在繼續在其他第二階段和第三階段試驗中研究 Winrevair ,這些試驗包括對患有較晚期 PAH 疾病的患者以及診斷後第一年內的患者進行的後期研究。默克表示,預計這些試驗將在 2025 年和 2026 年左右完成。
市場競爭者眾
嬌生、 Gilead Sciences ; United Therapeutics、 Bayer 、Aerami Therapeutics 、Novartis(諾華)、 GSK、 Teva、Lupin 和輝瑞( Pfizer)
延伸閱讀: 《肺動脈高壓》United Therapeutics(聯合治療)肺動脈高壓吸入性藥物專利判決出爐!Liquidia的Yutrepia最快2024年上市
關於肺動脈高壓 (PAH)
肺動脈高壓 (PAH) 是一種罕見的、進行性和危及生命的血管疾病,其特徵是小肺動脈收縮和肺循環血壓升高。美國大約有 40,000 人患有 PAH。許多患者的疾病進展迅速。PAH 會對心臟造成顯著壓力,導致身體活動受限、心力衰竭和預期壽命縮短。PAH 患者的五年死亡率約為 43%。
關於 sotatercept: WINREVAIR
Sotatercept 是一種激活素信號抑製劑生物製劑,用於治療 PAH(WHO 第 1 組)。PAH 是一種罕見疾病,部分原因是肺部動脈壁細胞過度增殖,導致狹窄和異常收縮。Sotatercept 已獲得美國食品和藥物管理局 (FDA) 授予的突破性治療指定和孤兒藥指定,以及歐洲藥品管理局授予的用於治療 PAH 的優先藥物指定和孤兒藥指定。默克以115億美元收購 Acceleron Pharma Inc. 獲得了sotatercept 在肺動脈高壓領域的獨家權利。