《生物相似藥》全球最大市場: 歐盟呼籲互換性! 允許藥房/藥師自動替代生物相似藥
日期 : 2022/9/28
作者 : 王裕誠 (生技投資第一站)
生物相似藥是指以生物技術衍生之生物製劑藥品,在品質、安全和療效上與原廠開發的生物製劑相似。為了驗證與參考藥物(原廠)的療效有其安全性,通常必須執行隨機、平行的療效比較試驗,且以雙盲為佳。上市前的臨床試驗通常不足以識別初期安全差異,必須上市後持續藥品的監控,進行利益風險的評估。(延伸閱讀: 《生物相似藥》最大挑戰在量產! 一期臨床達標的內涵及其價值 (閱讀))
由於生物相似藥與原廠參考藥品的臨床試驗只能顯示其療效相似性,所以無法適用小分子學名藥與原廠藥互換的原則。根據美國法規,需進行彼此互換多次之臨床試驗,且證明無安全疑慮,才能在仿單上宣稱藥品互換性(interchangeability)。美國每個州都已經通過了法律,允許或要求藥劑師在某些情況下分配可互換的生物仿製藥,但他們不會在醫生不知情的情況下這樣做。

早在2006就通過第一項生物相似藥的歐盟表示,歐洲擁有世界上最大的生物相似藥市場,並且每年都在增長。截至目前,已有 86 種生物仿製藥獲得 EMA 批准。在審查了 100 多份生物類似藥候選提交、授權生物類似藥並監測其安全性超過 15 年之後,EMA認為,與參考產品相比,已批准的生物仿製藥已證明具有可比性的功效、安全性和免疫原性。因此,不需要額外的系統轉換研究來支持歐盟批准的生物仿製藥在處方水平上的互換性。
會員國將繼續決定在每個領土上哪些生物藥物可用於開處方,以及是否允許在藥房可以互換生物相似藥。
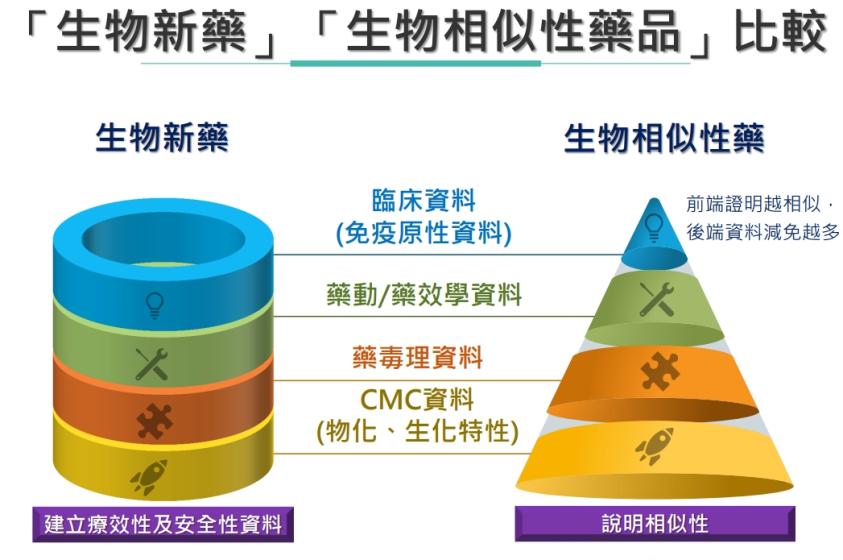
資料: 醫藥法規月刊、GaBi、TFDA

.jpg)
.jpg)

