《CAR-T》同種異體進入二期臨床試驗 ! Allogene單次CAR-T生產可供百名病患使用
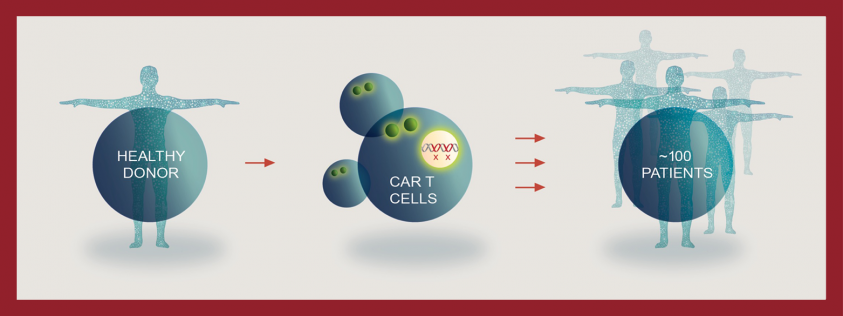
Allogene 正在努力通過創造研究同種異體 CAR-T 細胞產品-AlloCAR T ™產品,來克服自體 CAR-T 療法的局限性。與自體細胞療法不同,AlloCAR T™ 產品使用來自健康供體的 T 細胞。

這些細胞在製造設施中被分離出來,經過工程改造以表達 CAR 以識別和破壞癌細胞,並通過基因編輯進行修飾以限制給予患者時的自身免疫反應。然後將這些產品存儲起來以供按需 使用。在規模上,一次生產運行就有可能為 100 多名患者提供治療。
10/6日,Allogene宣布,啟動ALLO-501A 用於復發/難治性 (r/r) 大 B 細胞淋巴瘤 (LBCL) 之二期臨床試驗(ALPHA2)。一 期試驗的臨床和轉化數據顯示,當與包括優化劑量 ALLO-647 的淋巴清除方案一起使用時,單劑量 ALLO-501A 可實現較高的反應率。
二期臨床試驗設計
1.將招募100名已經接受過兩線治療且之前沒有接受抗-CD19的治療
2. 單臂試驗,將利用單劑ALLO-501A含1.2億CAR+細胞加上必須的淋巴清除(FCA90,fludarabine (30 mg/m2/day x 3 days) + cyclophosphamide (300 mg/m2/day x 3 days) + ALLO-647 (90 mg))
3.主要觀察指標: 客觀反應率(ORR)
取得FDA「再生醫學新興療法」資格
6 月,FDA 授予 ALLO-501A 在 r/r LBCL 中的「再生醫學新興療法」(Regenerative Medicine Advanced Therapy 簡稱RMAT)資格。先前提供的數據支持 ALLO-501A 作為已批准的自體 CAR-T 療法的替代選擇。在 ALLO-501A 1 期研究中,幾乎所有入組患者都能接受治療,從入組到開始治療的中位時間為兩天。
Allogene 預計將在 2022 年底提供其 CD19 計劃的更新,包括 ALPHA 和 ALPHA2一期試驗的長期隨訪。Allogene 的 AlloCAR T™ 程序利用 Cellectis TALEN ®技術。ALLO-501 和 ALLO-501A 是根據雙方的合作協議共同開發的抗 CD19 產品服務商
延伸閱讀: 《CAR-T》Autolus授權施貴寶使用RQR8安全開關系統RQR8,以降低治療毒性
延伸閱讀: 2021年3/26日,《FDA》通過必治妥施貴寶/藍鳥生物的 BCMA CAR-T 細胞療法Abecma 治療多發性骨髓瘤
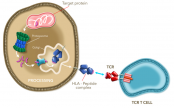
自體CAR-T治療的困境


.jpg)