《Covid-19》Gilead的瑞德西韋remdesivir治療新冠肺炎中國輕度到重度兩項臨床試驗皆喊停! 三大原因導致收案不如預期
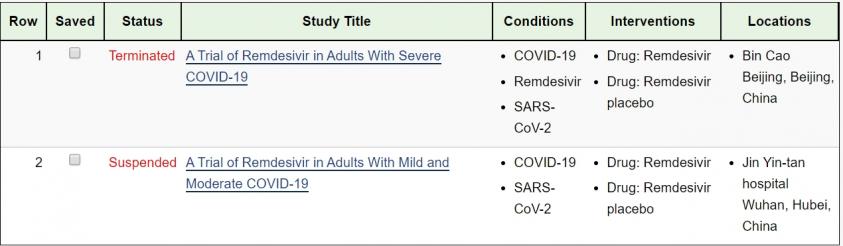
4/14日Genet就報導,Gilead的瑞德西韋remdesivir在世界各地正在進行七項臨床試驗,雖然中國重症者臨床試驗因收案困難而終止,但全球其他臨床試驗的數據可望在最近兩個月公布。
不過4/15又傳來,由於缺乏合格的患者,中國輕度和中度患者臨床試驗又暫停,這也導致公司股價下跌至74.63美元,跌幅超過4%。當初市場都認為中國病患多,收案應該不是問題,但現在兩項臨床試驗都喊停的應該與「水土不服有關」。
收案標準:
所有參與者均需測試COVID-19病毒呈陽性 (檢測也是問題??)
1. 重病患者必須在發病後12天內,並且在過去30天內不能接受其他治療
2. 對試驗感興趣的輕度和中度患者必須在發病八天內
收案不如預期
1. 大多患者在家裡根據中國媒體或是網路上所推薦的療法已經開始自行治療
2. 所有參與者均需測試COVID-19病毒呈陽性,但一些試驗室的檢測也發生偽陰性的問題,這都導致收案進行緩慢
3. 已經招募而預定要去醫院接受治療的患者,最後決定不去醫院,因害怕感染,根據報導有一半的患者是從醫院感染
臨床試驗簡要:
2019年12月,中國湖北省武漢市成為原因不明的肺炎暴發的中心。在短時間內,中國科學家分享了來自這些肺炎患者的新型冠狀病毒(SARS-CoV-2)的基因組信息,並開發了實時逆轉錄PCR(實時RT-PCR)診斷檢測方法。
根據針對SARS-CoV和MERS-CoV感染的臨床前研究,鑑於沒有針對COVID-19的特異性抗病毒治療以及瑞德西韋remdesivir作為潛在的抗病毒藥物的可用性,臨床試驗設計為該隨機,對照,雙盲試驗將評估該藥的療效和安全性
|
招募
對象
|
開始
時間
|
完成
時間
|
觀察 | 研究完成日期 | 治療方式 |
|
重症者
452人
|
2020
02.05
|
2020
04.03
|
28天 |
2020
05.01
|
在第1天給予200毫克劑量Remdesivir,然後每天一次100毫克靜脈內維持劑量,持續9天。 |
|
輕/中度者
308人
|
2020
02.05
|
2020
04.10
|
28
天
|
2020/
04.27
|
在第1天給予200毫克劑量Remdesivir,然後每天一次100毫克靜脈內維持劑量,持續9天。 |




