《COVID-19治療》對巴西與南非變異株效果較差!FDA 5/27 宣布六州暫停使用禮來Bamlanivimab+Etesevimab抗體合併療法!
秒速閱讀:FDA於5/27對外宣布於美國六州內暫停使用禮來(Eli Lilly)旗下針對COVID-19之Bamlanivimab+Etesevimab合併療法,並建議改為使用Regeneron旗下對巴西與南非變異株更為有效的REGEN-COV抗體療法來治療輕症至中症之新冠肺炎患者。《COVID-19疫苗》變種病毒來勢洶洶!各大新冠疫苗對於英國、南非、巴西、印度變異株到底還具有多少保護力?(閱讀)
就在GSK與Vir Biotechnology共同開發之COVID-19抗體藥物sotrovimab於5/27獲美國FDA批准緊急使用授權(EUA)的幾個小時後,FDA旋即針對禮來(Eli Lilly)早在今年2月即獲EUA的Bamlanivimab+Etesevimab抗體合併療法暫停於美國六州內使用。(延伸閱讀:《FDA》核准禮來中和性抗體(bamlanivimab+etesevimab)合併療法用於新冠輕中度之緊急使用授權EUA)
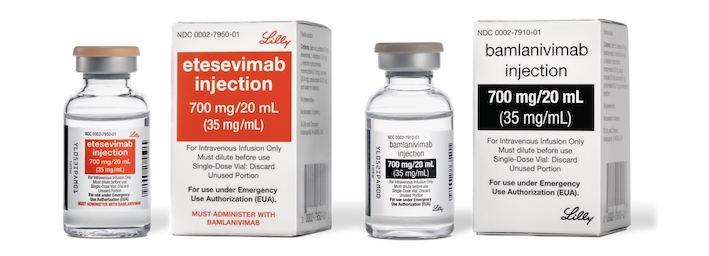
目前,FDA已停止Bamlanivimab與Etesevimab合併療法在亞利桑那州、加利福尼亞州、佛羅里達州、印第納州、俄勒岡州以及華盛頓州內進行分發,而這六州均是巴西P.1(Gamma)與南非B.1.351(Beta)變種病毒佔總確診患者10%以上的地區。對禮來而言,FDA才於4/16宣布撤回其單株抗體bamlanivimab的緊急使用授權,這次合併療法失利無非是一個巨大的打擊。(延伸閱讀:《COVID-19治療》禮來單株抗體 bamlanivimab 對新冠變體中和能力降低或喪失,FDA 4/16日撤回單獨使用EUA)
然而FDA此次的行動也非空穴來風,由於許多研究表明新興變種病毒,特別是南非變異株B.1.351對於新冠抗體療法的抵抗力增強,因此早在今年3月就已下令Regeneron以及禮來需針對旗下抗體療法對變種病毒進行進一步的療效評估與追蹤,並要求每個月提供分析摘要。(延伸閱讀:《FDA》【對EUA附加了兩個新條件】要求禮來以及Regeneron對變種病毒進行抗體療效追蹤!)
FDA表示根據實驗室研究表明,Regeneron的抗體合併療法REGEN-COV對巴西P.1以及南非B.1.351變異株的治療更為有效,並建議這六州的供應商可改為採用此抗體療法。(延伸閱讀:《COVID-19治療》Regeneron抗體療法臨床數據佳!對無症狀感染者以及先前未感染者均能降低疾病進展風險!)
資料來源:Fierce Pharma, FDA
更多資訊,請參考今日彙整。