《思覺失調》療效與副作用優潛在年銷售62億美元!! 數十年來首款「新類別」候選藥物 KarXT, FDA 將於 2024 第三季決定是否批准
Karuna Therapeutics 的思覺失調症治療藥物 KarXT (xanomeline-trospium) 的新藥申請,已於 2023 年 11 月 29 日獲得美國 FDA 接受,審批時程為 2024 年 9 月 26 日。KarXT 採用了一種新的藥理學方法,因此該藥若獲批准,將成為幾十年來首個治療思覺失調症的新藥類別;瑞穗證券分析師則預測 KarXT 將有巨大潛力,全球銷售額高峰估計為 62 億美元。
Karuna 於 2023 年 9 月提交了 KarXT 申請,並提供了臨床試驗「EMERGENT-1」、「EMERGENT-2」和「EMERGENT-3」三項已完成的安慰劑對照試驗的資料作為支援,這三項試驗共同證明了該藥物對於患者在正性和負性症狀量表 (PANSS) 總得分「具有統計學意義和臨床意義的改善」。
在安全性方面,3 項試驗都證實 KarXT 的耐受性普遍良好。最常見的不良反應是膽鹼能性質的副作用,程度為輕度至中度。但重要的是,KarXT 不會引發體重增加、運動障礙和嗜睡等現有抗精神病藥物的常見副作用。
KarXT
是一種研究中的蕈鹼類 (muscarinic) 抗精神病治療藥物,與現有的思覺失調症治療藥物不同,它不會直接阻斷多巴胺受體,而是透過雙重 M1/M4 蕈鹼類乙醯膽鹼受體 (muscarinic acetylcholine receptor),作用於中樞神經系統一個被認為可以控制思覺失調症正性、負性和認知症狀的區域,進而改善患者的這些症狀。(延伸閱讀: 《思覺失調》Karuna Therapeutics候選新藥 KarXT不依賴多巴胺能或血清素治療! 分析師估銷售可達44億美元)
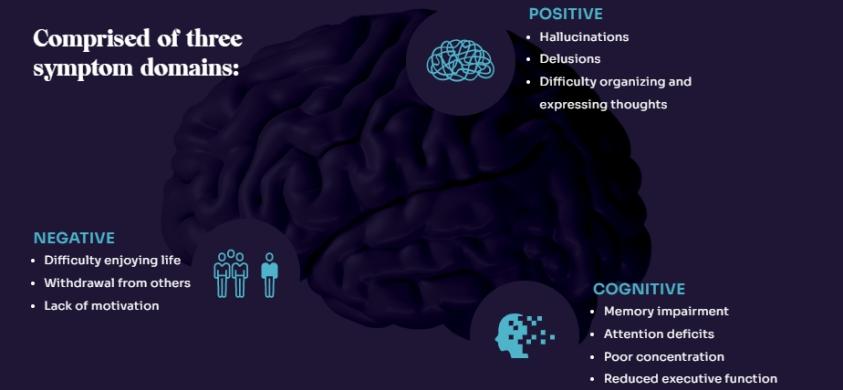
目前所有獲批的思覺失調症治療藥物都只針對正性症狀 (妄想和偏執等) 做改善,但 KarXT 在「EMERGENT-1」和「EMERGENT-2」中證實了 KarXT 對負性症狀 (社交退縮、冷漠、缺乏動力和說話困難等) 有益,這是 KarXT 能夠不同於其他藥物的主要優勢。
* 整個 EMERGENT 開發專案除了上述三項試驗之外,還包括了「EMERGENT-4」和「EMERGENT-5」兩項試驗,其目的試驗在研究 KarXT 的長期安全性。
全球有2100萬人受精神分裂症之苦
其中大多數人在 18 個月內停止服用目前的抗精神病藥物治療方案。社交退縮、幻覺、妄想、記憶擦除、決策障礙和其他症狀是該病症的標誌。
延伸閱讀:《思覺失調》長效注射型抗精神病藥物可提升思覺失調症患者治療依從性、降低復發率,亞洲患者一樣有效
延伸閱讀:《思覺失調》看不到前景!羅氏再度終止候選新藥 ralmitaront 二期臨床試驗
資料來源:BioSpace、Fierce Biotech





