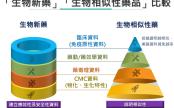
《生物相似藥 》挽頹勢!禮來/中國信達為肺癌新藥PD-1抑制劑 sintilimab 提供40% 大折扣,直接和生物相似藥競爭
美國 FDA 對於禮來 (Eli Lilly) 的 PD-1 候選藥物 sintilimab 的申請,似乎鐵了心要拒絕到底?來自 FDA 的關鍵決策者 ─ 腫瘤學卓越中心主任 Richard Pazdur,甚至明確表示他將爭取撤消該藥物的申請。(延伸閲讀:【中美之戰】是政治還是科學 ? ? 禮來與中國信達肺癌新藥(PD-1抑制劑sintilimab )臨床試驗受FDA質疑 (必讀))
禮來公司也採取反擊行動,發表了一項聲明,其中述及了PD-1抑制劑類藥物在過去的幾年裡,一直是腫瘤學藥物支出居高不下的因素;而禮來將為該藥物 (如果順利獲得批准的話) 提供 40% 的折扣,直接逼近生物相似藥的折扣,並說此定價策略將可為美國醫療系統節省數十億美元。最後話鋒一轉,補了一段:「話雖如此,該藥物目前在美國還沒有得到批准,也可能不會得到批准。我們認為尊重 FDA 的程序很重要。」
這招彷彿有意使 FDA 陷入一場新的公眾爭議,也就是:領導者是如何挑選「哪些藥物必須接受最高的黃金標準衡量、哪些療法可以獲得通過」?
FDA 的 Pazdur 主任表示,他們並不反對在中國開發藥物,但主要問題是,這些結果是否也可以在美國人身上再現?不過,這樣的論點與標準,似乎又與 FDA 過往曾採用中國的資料進行審批的立場不同。
此外,到目前為止,已被批准的 PD-(L)1 藥物都在市場上佔據了自己的位置,堅持以高昂的價格銷售,而過去 Pazdur 主任也對新加入該市場的藥物「遵循先前的 (高價) 定價策略」持批評態度。而今日,若是有個「便宜又好用」、可與市場上某些重要 PD-(L)1 藥物互換的藥物,FDA 卻拒絕批准,那麼 FDA 是否該要好好解釋一番?
走到這個階段,禮來想說:我的藥便宜又好用,請讓我通過!
FDA 則想表達:不是錢的問題,是這藥究竟對我美國人有沒有效?(會這麼要求似乎也是無可厚非) 。
因此,毫無意外地,2 月 10 日召開的 FDA 腫瘤藥物咨詢委員會最後決議:在 sintilimab 獲得批准前,製藥商必須補充額外臨床試驗,以驗證 sintilimab 在美國人群和美國臨床醫療的適用性。2/10日腫瘤藥物諮詢委員會 (ODAC) 以 14-1 的投票要求sintilimab須在美國進行一項新的臨床試驗。
資料來源:Endpoints News、PR Newswire