《基因療法》史上最貴藥! 諾華(Novartis) Zolgensma發生兩起死亡事件,基因療法肝臟安全性成為關注焦點
諾華 (Novartis) 8 月 11 日證實,俄羅斯和哈薩克的兩名兒童在接受脊髓性肌肉萎縮症 (SMA) 基因療法Zolgensma治療約 5~6 週後、且皮質類固醇逐漸減量開始後約 1~10 天,因急性肝臟衰竭而死亡。雖然「嚴重的肝臟損傷」是Zolgensma的已知風險,但這兩例卻是首次發生的致命案例。
諾華表示將請美國 FDA 以及其他監管機關更新Zolgensma的標籤,納入說明已經發生了的致命急性肝臟衰竭,並強調,這是一個重要安全資訊,但並非「新的」安全訊號;迄今為止,Zolgensma已在臨床試驗、管理使用計畫和商業環境等方面,治療了全球2,300多名患者,因此諾華堅信Zolgensma的總體風險/效益狀況良好。(延伸閱讀: ⟪基因療法⟫ 史上最昂貴的藥!英國NICE建議將諾華179萬英鎊的基因療法Zolgensma納入第一型SMA治療指南)
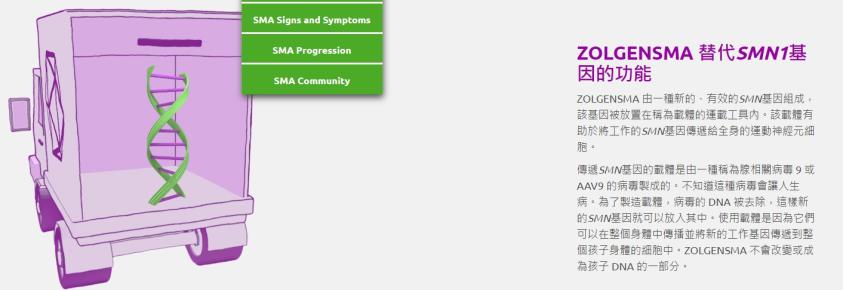
儘管如此,一劑藥價210萬美元的Zolgensma仍引發不少的安全性爭議,包括:
自 2019 年美國 FDA 批准以來,Zolgensma已陸續在40 多個國家獲得批准,並已成為一種重要療法。它在今年第二季創造了 3.79 億美元的銷售額,同比增長26%。這種單次基因療法擠壓了百健 (Biogen) Spinraza的市場,但同時也面臨著來自羅氏 (Roche) 口服藥物Evrysdi的競爭。而除了目前的靜脈注射劑型外,諾華還在開發脊髓鞘內注射劑型,期望能讓年齡較大的 SMA 患者也能夠接受基因療法。
* 事實上,肝臟毒性是這類「以腺相關病毒 (AAVs) 為載體的基因療法」最常見的副作用之一,最著名的嚴重肝臟毒性案例之一發生在安斯泰來 (Astellas) AT132 (X 連鎖肌管性肌病的基因療法) 的臨床試驗中:最初 17 名接受高劑量研究性療法的兒童中,有3 人在出現肝臟衰竭後死亡;在臨床試驗遭到擱置、又再度取消後,安斯泰來以較低 (可能相對較安全) 的劑量治療患者,但再度出現第四名肝功能異常個案,該名患者在 2021 年 9 月死亡。
延伸閲讀:《基因療法》提交全面非臨床毒理數據! FDA 解除諾華 (Novartis) 脊髓性肌肉萎縮症 (SMA) 基因治療部分臨床擱置
延伸閲讀:《基因療法》輝瑞重啟杜興氏肌肉萎縮症基因療法 III 期試驗,力拼 2023 年底取得 FDA 批准
沒有足夠的 SMN 蛋白,運動神經元細胞停止工作,肌肉變得虛弱.....

資料來源:Fierce Pharma、Reuters、BioPharma Dive

.jpg)