《基因療法》受試者診斷出非預期性血癌?! 藍鳥生物LentiGlobin鐮刀型貧血症臨床試驗喊停!股價暴跌34%(閱讀)
秒速閱讀:藍鳥生物公司(Bluebird bio)宣布因一名受試者診斷出急性骨髓性白血病(Acute myeloid leukemia, AML)的非預期嚴重不良反應,已暫停其針對鐮刀型紅血球貧血症的LentiGlobin基因療法I/II以及III期臨床試驗,消息一出,公司股價暴跌34%。
HGB-206為藍鳥生物LentiGlobin基因療法用於治療鐮刀型紅血球貧血症(Sickle-cell disease, SCD)的I/II期臨床試驗,試驗包括A、B以及C三個組別,相較於A與B組使用骨髓搜集之造血幹細胞(Hematopoietic stem cell, HSC),C組則是使用plerixafor驅動後自周邊血收集之造血幹細胞來製造能夠治療SCD之LentiGlobin。 HGB-210為另一單臂開放標籤的III期臨床試驗,旨在評估LentiGlobin對2至50歲SCD患者的治療有效性和安全性。
延伸閱讀:遺傳性疾病鐮刀形血球貧血症治療 評bluebird bio基因療法 LentiGlobin與全球血液公司 Oxbryta (閱讀)
在HGB-206試驗A組中,一名5年多前接受治療的患者最近被診斷患有急性骨髓性白血病(Acute myeloid leukemia, AML),藍鳥生物正在評估患者的白血病狀況,以決定是否將BB305慢病毒載體繼續用於治療SCD的LentiGlobin基因療法中。除了此非預期嚴重不良反應案例外,2月中在HGB-206試驗C組也出現了第二起患者罹患骨髓增生異常綜合症(MDS)的情形,目前均正在追蹤中。
藍鳥執行長Nick Leschly表示,公司另一個用於治療輸血依賴性β-地中海貧血(Transfusion-dependent beta-thalassemia, TDT)的一次性基因療法Zynteglo,與LentiGlobin都是使用同樣的BB305慢病毒載體,然而Zynteglo過去試驗中的患者均未出現過血液惡性腫瘤的案例,且該藥物已獲得歐盟和英國的許可。因此,藍鳥將致力與合作臨床研究的醫療單位以及監管機構共同評估LentiGlobin出現的嚴重不良反應病例。
LentiGlobin目前已獲得美國食品藥品監督管理局(FDA)的一系列資格認證,包括孤兒藥資格、快速審查資格、再生醫學新興療法(RMAT)以及罕見兒科疾病用藥認定資格。此外,也獲得了歐盟的孤兒藥產品資格以及歐洲藥品管理局(EMA)的優先藥品(PRIME)資格。
延伸閱讀:⟪FDA⟫ 毒理試驗發現藥物安全性疑慮!FDA通知暫停Spero旗下新型抗生素SPR720之IIa臨床試驗
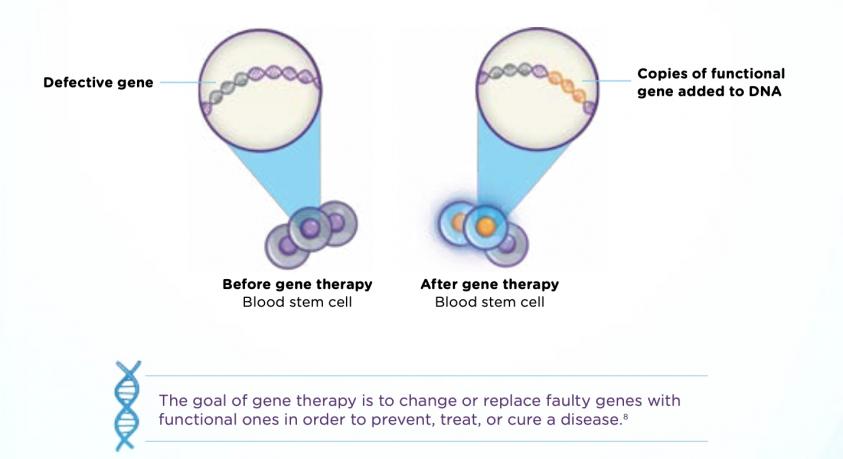
小知識:鐮刀型貧血症(Sickle-cell disease, SCD)屬於遺傳性疾病,主要是患者體內的血紅素(hemoglobin)發生基因變異而呈現鐮刀形狀,使得紅血球因為這些失常的血紅素聚合而改變形狀,以至於失去了攜帶氧氣的能力。這類基因缺陷疾病在一些新生兒篩查與診斷不普及的地區最為盛行,在非洲,由於缺乏早期診斷工具,鐮刀型貧血症佔5歲以下兒童死亡原因的5%。




