FDA新訊
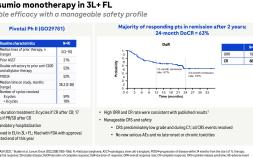
2022年12月23日,羅氏大藥廠宣布,美國FDA已核准 Lunsumio® (mosunetuzumab-axgb) 用於治療復發或難治性( R/R) 二線或多線...
科倫生物科技(四川科倫製藥有限公司的控股子公司)授權Merck七種用於治療癌症的研究性臨床前抗體藥物偶聯物 (ADC...
每天一分鐘瀏覽一下Genet觀點新聞,讓您跟上生技產業世界發展的新趨勢,同時可以了解各公司研發價值、競爭態...
秒速閱讀:FDA心血管與腎臟藥物諮詢委員會近日以8比3的票數反對Cytokinetics旗下治療心臟衰竭藥物Omecamtiv Mecarbil (OM...
秒速閱讀: 每天一分鐘瀏覽一下Genet觀點新聞,讓您跟上生技產業世界發展的新趨勢,同時可以了解各公司研發價...
美國食品藥物管理局(FDA)於1992年針對藥物審核建立了一套加速批准制度(Accelerated-approval program),主要是為急需藥物...
美國食品和藥物管理局 (FDA) 10 月 20 日發佈一份指南,做為臨床試驗在「同時觀察幾個指標」的情況下「該如何評...
經過多年的努力,阿斯利康 (AstraZeneca) 的免疫療法組合 Imjudo (抗 CTLA-4 抗體)/Imfinzi (抗 PD-L1 抗體) 在 10 月獲得批准...
ImmunoGen公司的新藥Elahere (mirvetuximab soravtansine) 是首個獲得 FDA 批准的用於鉑類耐藥疾病的抗體藥物偶聯物(ADC),這...
2022 年 11 月 14 日,羅氏大藥廠宣布FDA核准 VENTANA FOLR1 (FOLR1-2.1) RxDx 檢測,這是第一個免疫組織化學 (IHC) 伴隨診斷...
美國 FDA 日前就吉利德 (Gilead) 的抗 D 型肝炎病毒(HDV) 藥物「bulevirtide」的生物製劑許可申請(BLA),發出了完全回應...
秒速閱讀:輝瑞(Pfizer)和葛蘭素史克(GSK)為爭奪全球首個呼吸道融合病毒(RSV)疫苗市場份額備戰,兩家公司旗下開發...